Bild des Monats: Organ-on-Chip-Plattform Das Institut für Mikrotechnik entwickelt Chips zur Erforschung einer besseren Wirkstoffaufnahme im Körper
Tablette geschluckt – und dann? Wie gelangt der Wirkstoff dorthin, wo er im Körper ankommen soll? Wenn man weiß, wie das genau funktioniert, können Arzneimittel effizienter entwickelt und Tierversuche reduziert werden. Um das zu erreichen, baut das Institut für Mikrotechnik (IMT) Chips in Silizium-Technologie, mit denen die Wirkstoffaufnahme experimentell untersucht werden kann.
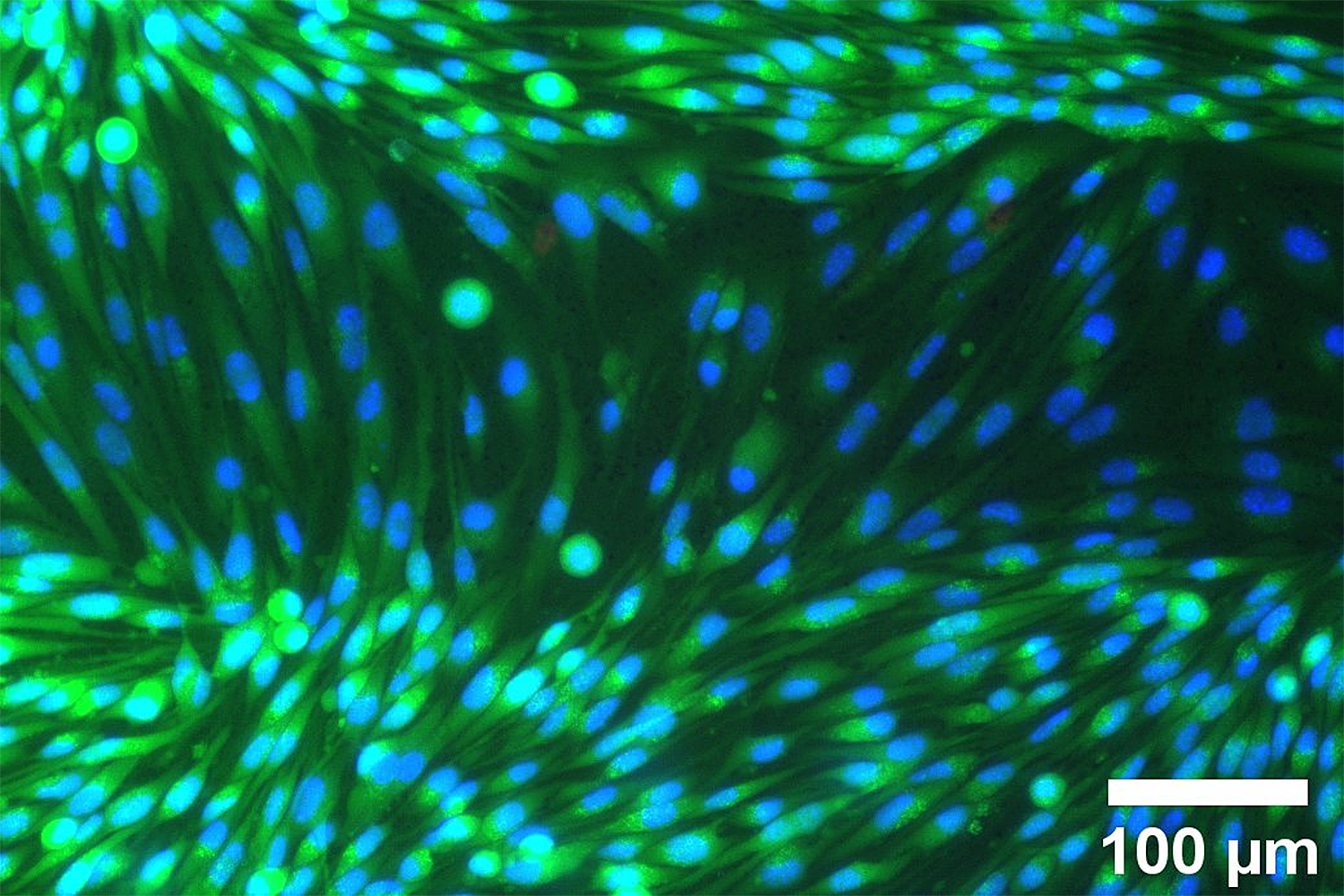
Angefärbte humane Endothelzellen (Zellschicht an der Innenfläche von Blut- und Lymphgefäßen, die die Wirkstoffe aus Arzneimitteln passieren lassen), die im Chip bei strömendem Medium kultiviert wurden. Bildnachweis: Bo Tang, Victor Krajka/TU Braunschweig
Die Wirkstoffe aus Arzneimitteln müssen das Endothel, also die Zellschicht an der Innenfläche von Blut- und Lymphgefäßen, durchqueren. Sie gelangen so in den Körper der Patient*innen und werden dann verteilt. Das Endothelgewebe stellt jedoch eine Transportbarriere für die Wirkstoffe dar. Um diese Vorgänge besser zu verstehen, wollen Wissenschaftler*innen am Zentrum für Pharmaverfahrenstechnik (PVZ) diese in vitro – unter experimentellen Bedingungen – beobachten. Möglich wird das durch eine neuartige Organ-on-Chip-Plattform mit MEMS-Verarbeitung auf Waferebene, an der das Institut für Mikrotechnik arbeitet.
Eine „Maschine“ auf kleinstem Raum
MEMS steht für Micro-Electro-Mechanical Systems und beschreibt die Verbindung von Mechanik und Elektronik auf engstem Raum, in dem Fall auf Waferebene, also in der Größenordnung von Siliziumchips. MEMS sind demnach kleine Maschinen oder Sensoren. Für das Studium des Endothelgewebes sind die Chips mit einer ultradünnen nanoporösen Membran und einem Bioimpedanzsensor ausgestattet.
- Organ-on-Chip Systeme im Entstehungsprozess im Reinraum während des Verbindens von Glas und Siliziumstrukturen (links). Bildnachweis: Bo Tang, Victor Krajka/TU Braunschweig
- Organ-on-Chip Systeme: Fertiger Chip (1cm x 1cm) mit Elektroden zur Impedanzspektroskopie auf einer 500 Nanometer dünnen Membran mit Nanoporen. Bildnachweis: Bo Tang, Victor Krajka/TU Braunschweig
Die Chips bestehen aus zwei Kanälen, die durch eine permeable Membran getrennt sind. Der eine Kanal stellt den Gefäßinnenraum dar, der andere das umliegende Gewebe. Auf dieser Membran wachsen Zellen, die dadurch ihre Barrierefunktion ausbilden. Je dichter die Zellen wachsen, desto höher ist die Barrierefunktion.
Der Bioimpedanzsensor ist auf dem Chip integriert, genauer gesagt, auf der ultradünnen nanoporösen Membran, auf dem die Zellen wachsen werden. Zur Messung der Impedanz wird ein Wechselstrom angelegt. Je nach Widerstand bzw. Frequenz kann zwischen Zelldichte oder Zell-Zellkontakt-Stärke unterschieden werden. Dies ist eine sehr nützliche Methode, um die biologische Barriereintegrität während Wirkstoffbehandlungen in Echtzeit zu ermitteln.
Das gesamte Projekt profitiert von der multidisziplinären Zusammenarbeit zwischen den Arbeitsgruppen von Andreas Dietzel, Stephan Reichl, Iordania Constantinou, die im Zentrum für Pharmaverfahrenstechnik (PVZ) stattfindet.


